yl12311线路检测王金星教授团队近期在PNAS杂志上发表了题为《Scavenger receptor B2, a type III membrane pattern recognition receptor, senses LPS and activates the IMD pathway in crustaceans》的文章,利用重要水产养殖物种对虾为研究模型,发现了一种III型跨膜蛋白—B类清道夫受体(SRB2, 属于CD36样蛋白)是甲壳类动物激活IMD途径的膜受体。SRB2通过其胞外结构域识别来源于细菌的病原相关分子模式—脂多糖(LPS),其胞内结构域通过同型相互作用样基序(cRHIM)与其适配分子IMD蛋白相互作用,激活NF-kappa B样转录因子—Relish入核,调控抗菌肽基因的表达,发挥抑制病原微生物感染的作用。

无脊椎动物的免疫缺陷(IMD)信号途径类似于哺乳动物的肿瘤坏死因子受体(TNFR)途径,在先天免疫防御中发挥至关重要的作用。在果蝇中,肽聚糖识别蛋白(PGRPs)作为IMD途径的膜受体和胞内受体,能够识别来源于细菌的二氨基庚二酸(DAP)型肽聚糖,激活该途径以产生抗菌肽等效应分子,抵抗细菌等病原的感染。然而,PGRP基因在甲壳动物亚门多个纲的基因组数据库中均未检索到,但是IMD途径在这些动物中依旧发挥重要的抗菌功能。在缺失PGRPs受体的情况下,IMD信号途径是如何被激活的多年来一直是个谜。
虽然果蝇等无脊椎动物的IMD信号途径与哺乳动物的TNFR途径相似,但其受体和适配分子IMD与哺乳动物没有明确的同源性,IMD途径是否使用保守机制驱动该信号通路的激活也是从发现IMD信号通路以来悬而未决的问题。有报道称果蝇IMD途径的激活可能与哺乳动物相似,通过同型相互作用样基序(cRHIMs)形成功能性淀粉样蛋白聚集体作为信号驱动的平台。王金星教授团队研究表明,对虾IMD途径的受体SRB2和适配分子IMD可以分别通过其胞质C端和N端结构域形成聚集体,这种淀粉样原纤维集聚体的形成是驱动对虾IMD信号通路所必需的,表明对虾IMD信号的驱动在进化上是保守的。该研究不仅揭示了IMD信号途径的变异性和可塑性(甲壳类的SRB-IMD-RELISH途径不同于果蝇的PGRP-IMD-RELISH途径),同时也阐释了IMD信号传递的在进化上的保守性。这些发现说明研究非模式生物对揭示进化免疫学相关理论的重要性,同时也为对虾病害防控中免疫刺激剂的筛选和利用提供了理论基础。
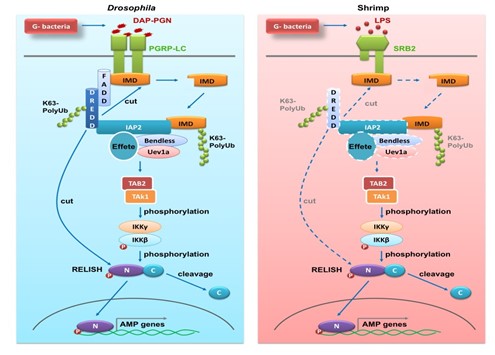
图1. 果蝇和对虾IMD信号途径组成比较示意图
yl12311线路检测石秀贞副教授和杨明冲博士为该论文的并列第一作者,王金星教授为通讯作者(全文链接https://doi.org/10.1073/pnas.2216574120)。57365线路检测中心官网为第一和通讯作者单位。该研究得到国家自然科学基金重点和面上及科技部重点研发计划等项目的资助。
王金星教授课题组在国家自然科学基金和科技部重点研发计划等项目的资助下,聚焦水产无脊椎动物动物免疫与病害防控开展研究,近年来还取得了下列系列研究进展。
在对虾肠道菌群动态平衡调控方面:他们发现叉头框蛋白O (FOXO)在正常对虾中具有基础水平的表达,通过调控IMD途径转录因子Relish,进而调控抗菌肽的低水平表达,维持正常对虾血淋巴和肠道微生物菌群的稳态。在鳗弧菌感染的对虾中,FOXO显著上调表达,同时丝氨酸/苏氨酸蛋白激酶AKT的活性降低,导致FOXO磷酸化降低,从而诱导FOXO的核易位,直接促进靶基因抗菌肽和Relish的高表达,以抵抗鳗弧菌感染。总之, FOXO通过调控抗菌肽的表达从而发挥其对虾类血淋巴和肠道菌群稳态的调控功能。相关研究发表在PLoS Pathogens 杂志(2021),博士生李苍为第一作者,王金星为通讯作者(doi: 10.1371/journal.ppat.1009479)。
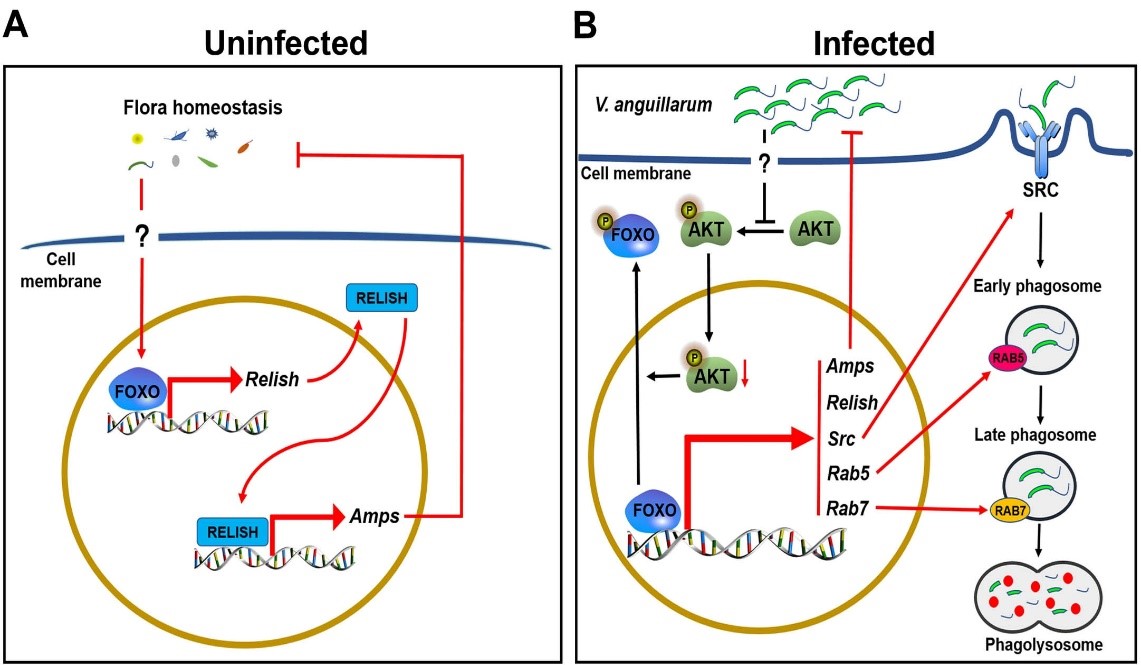
图2. FOXO参与对虾的肠道菌群动态平衡调控的示意图
课题组建立了对虾感染白斑综合征病毒(WSSV)的实验模型,利用16S RNA测序方法研究了WSSV感染对对虾胃肠道不同部位(贲门胃、幽门胃和肠道)菌群的影响。分析鉴定到了34个门和576个属的肠道菌。WSSV感染不同程度地降低了对虾胃肠道内的微生物多样性,且呈时间依赖性。WSSV感染主要影响了两个胃的微生物组成,但对肠道菌群影响不明显。WSSV感染还会导致肠道菌群部分功能的丧失。这项研究有助于了解甲壳类动物胃肠道中的细菌-病毒相互作用,并为病原体的预防、控制和水产可持续养殖提供理论基础。相关研究发表在Science of the Total Environment(2022)。牛国娟博士为论文的共同第一作者,王金星教授为通讯作者(doi: 10.1016/j.scitotenv.2022.156233)57365线路检测中心官网为第一和通讯作者单位。
在宿主与病原体互作研究方面:发现WSSV与其受体pIgR的胞外结构域结合,胞内域招募钙调蛋白CaM,促进病毒内吞;同时CaM与AKT的PH结构域结合,促进了AKT的磷酸化。活化的AKT激活mTORC1信号途径,进一步激活其下游效应分子4EBP1、S6Ks,促进病毒蛋白质的合成,最终促进WSSV在对虾体内的增殖(图3)。本论文揭示WSSV通过pIgR侵染对虾后激活mTORC1途径,有利于病毒的复制的新机制,并为对虾抗病品系的培育提供了新靶标。相关研究发表在PLoS Pathogens(2022)。课题组硕士研究生洪盼盼为第一作者,王金星教授为通讯作者(doi: 10.1371/journal.ppat.1010808)。
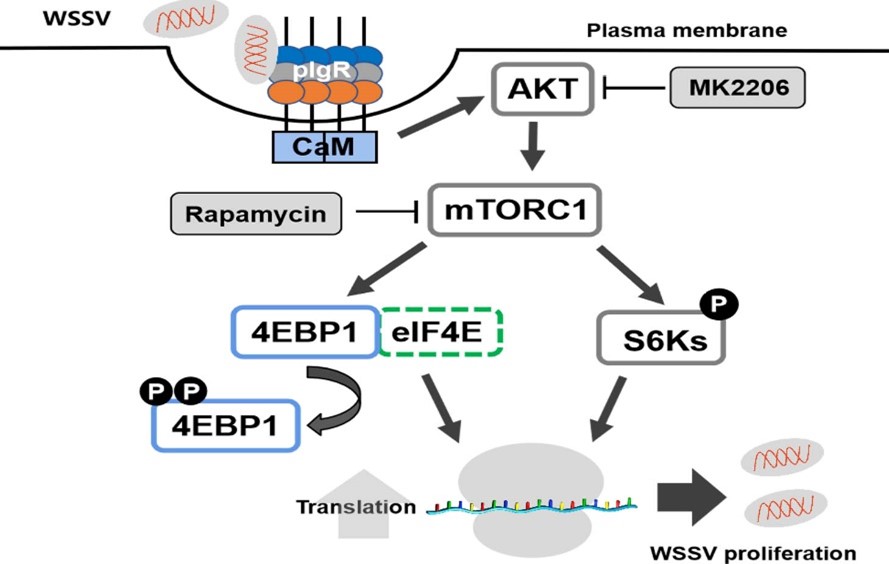
图3. WSSV介导的通过pIgR-CaM-AKT-mTORC1信号级联激活mTORC1信号通路示意图
课题组研究还发现腺苷酸活化蛋白激酶(AMPK)在白斑综合征病毒感染对虾中直接激活mTORC2-AKT信号通路,磷酸化胞质内糖酵解途径的关键酶,导致糖酵解增加,为WSSV增殖提供能量(图4)。相关研究发表在Communications Biology,(2023)。课题组张鹏博士和硕士生付海晶为论文的共同第一作者,王金星教授为通讯作者(doi: 10.1038/s42003-023-04735-z)。
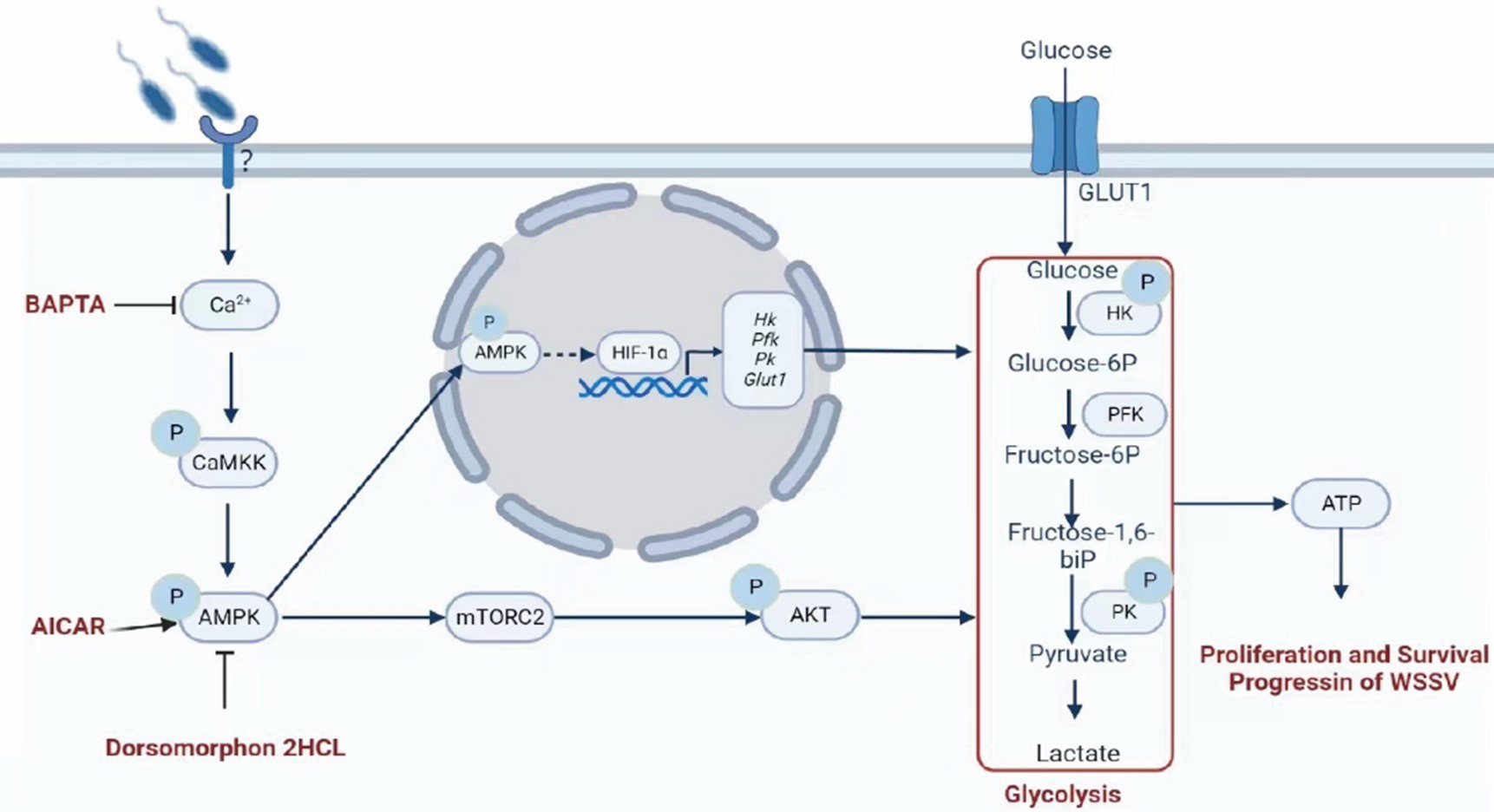
图4.病毒感染对虾中WSSV激活mTORC2-AKT信号通路,促进糖酵解,为WSSV增殖提供能量示意图
